Thema 6: Zukunft des Menschen
Genetik – einige historische Meilensteine
1865 – Der Wissenschaftler Gregor Mendel studiert die Vererbung bestimmter Merkmale in der Züchtung von Erbsen und destilliert aus seinen Experimente drei Regeln des Vererbungsvorgangs.
1889 – Der Biologe Hugo de Vries postuliert, dass Vererbung mittels bestimmter Partikel stattfindet, die er „Pangene“ nennt – der Begriff wird später auf „Gene“ verkürzt.
1902 – Die Chromosomentheorie der Vererbung wird von Walter Sutton und Theodore Boveri (unabhängig voneinander) entdeckt – sie verweist auf materielle Träger für genetische Informationen der Vererbung: Chromosomen.
1910 – Thomas Hunt Morgan entdeckt die Anordnung von Genen auf Chromosomen und die Vererbung nebeneinanderliegender Gene durch Genkoppelung, er kartografiert die Reihenfolgen und Abstände von Genen.
1953 – Basierend auf Analysen und Berechnungen der Biochemikerin Rosalind Franklin veröffentlichen die Molekularbiologen Francis Crick und James Watson im April 1953 einen Artikel, der die Struktur von DNA als Doppelhelix aufzeigt.
1973 – Den Genetikern Stanley Cohen und Herbert Boyer gelingt es erstmals rekombinante (also im Labor künstlich zusammengesetzte) DNA zu erschaffen
1980 – Eine Methode zur Entschlüsselung von Genomen wird entwickelt. Das erste Patent für genetisches Klonen wird von der Stanford University angemeldet.
1990 – Das Human Genome Project startet mit der Entschlüsselung des menschlichen Genoms – im Jahre 2003 wurde es erfolgreich beendet. Damit ist der Aufbau des menschlichen Genoms bekannt, wenn auch nicht die Funktion der einzelnen Gene.
1997 – Dolly das Schaf ist das erste geklonte Säugetier der Welt.
2012/15 – Mit der CRISPR/Cas9-Methode wird erstmals eine (relativ) verlässliche und präzise Methode entwickelt, Gene zu editieren – sie also gezielt auszuschneiden oder zu verändern.
CRISPR und was möglich ist
Die Methode erlaubt es, mit Hilfe eines Teils des Immunsystems von Bakterien, die DNA von Organismen zu editieren, also Teile zu entfernen oder durch andere DNA zu ersetzen. Das bedeutet, dass man unerwünschte oder potentiell fehlerhafte (also etwa Krankheiten auslösende) Gene entfernen oder durch gesunde Gene ersetzen könnte, vielleicht sogar neue und erwünschte (und positive Merkmale auslösende) Gene hinzufügen kann. Die Technologie steht noch am Anfang, aber das Potential scheint riesig. Doch auch die Risiken sind nicht zu unterschätzen, denn einzelne Gene können im Organismus diverse und nicht voraussehbare Funktionen haben. Die Löschung einzelner Gene könnte somit riskante Nebenwirkungen (wie etwa Krebsbildung) generieren. Problematisch ist aktuell auch noch, dass viele Krankheiten nicht durch ein Gen Ausdruck finden, sondern durch viele verschiedene – bis alle Gene identifiziert sind, die eine bestimmte komplexe Krankheit auslösen wird also noch Zeit vergehen.
Doch auch die weit näherliegenden Möglichkeiten von CRISPR sind mehr als überwältigend. Zum einen macht die präzise Anwendung des Edits es möglich, unsere Wissenslücken über die Funktionen des menschlichen Genoms zu füllen und somit potentiell die Genetik schneller voranzutreiben. Andere Anwendungsgebiete lägen in der Landwirtschaft oder der Pharmazeutik: Forscher entwickeln Edits, um Nahrungsmittel zu verändern und sie ertragreicher oder robuster zu machen. Denkbar ist auch etwa, die Allergene aus Erdnüssen zu entfernen oder spezielle Abwehrmechanismen gegen Schädlinge hinzuzufügen. Ebenso möglich sind Kühe, die für die Tierhaltung ohne Hörner geboren werden oder die Veränderung von Moskitos, so dass die Malaria nicht mehr übertragen werden kann. Doch auch die Pharma-Unternehmen hoffen auf CRISPR, etwa um neue Antibiotika gegen superresistente Keime zu entwickeln. Die Konsequenzen dieser neuen Entwicklungen, sowohl biologisch als auch ethisch, sind bislang nicht abzuschätzen und werden von der Politik ignoriert.
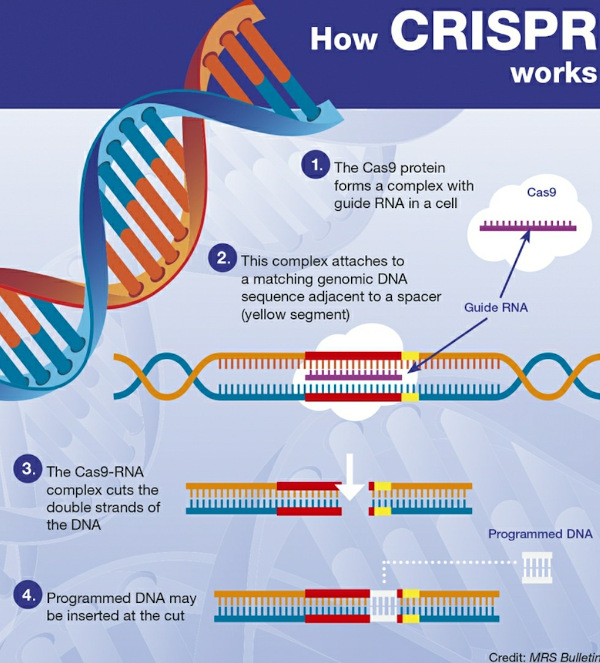
Bildquelle: MRS Bulletin, Artikel von Philip Ball (https://www.cambridge.org/core/journals/mrs-bulletin/news/crispr-implications-for-materials-science#)
Und der Mensch?
Gerade wenn es um die genetische Manipulation menschlicher Zellen geht, ist es wichtig ein paar grundlegende Punkte zu verstehen. Zum einen sind wir, wie bereits erwähnt, bisher nicht sicher, welche Gene welche Funktionen haben – wir haben zwar das Genom entschlüsselt (wissen, wo welches ist), die komplexen Zusammenhänge der einzelnen Gene aber keineswegs vollständig verstanden. Gene sind keine Knöpfe, die man an oder aus stellt, um ihre Funktion zu bestimmen. Vielmehr sind für bestimmte Funktionen, darunter auch Krankheiten, diverse (und eben teils unbekannte) Gene zuständig. Gene haben aber auch verschiedene und komplexe Funktionen, so dass das „Ausschalten“ eines fehlerhaften Gens wohlmöglich auch andere unerwünschte Nebenwirkungen haben könnte.
Zum anderen sind nicht alle genetischen Veränderungen gleich wirkungsvoll – in der Genetik wird hier vor allem zwischen somatischen Zellen und Zellen der Keimbahn („germ line“) unterschieden. Somatische Zellen zu verändern ist dabei nur für den einzelnen Organismus relevant, das Entfernen eines Krebs-auslösenden Gens etwa würde den Krebs dieses Organismus behandeln. Im Gegensatz dazu sind Keimbahn-Manipulationen relevant für die Weitergabe an die nächsten Generationen: hier den Krebs genetisch zu entfernen würde ihn für alle Nachkommen ebenfalls entfernen. Alle Veränderungen dieser Keimbahn-Zellen wären somit unwiderrufbar und für alle Nachfahren gültig, man würde ganze Generationen verändern.
Aus ethischer Sicht kann es also durchaus sinnvoll erscheinen, die CRISPR-Technologie dazu zu verwenden Gentherapien zur Behandlung von Sichelzellanämie, Krebs oder ALS zu entwickeln, die einzelnen Patienten mit akutem Krankheitsverlauf zu Gute kämen. Das Risiko ist hier überschaubar, wobei unvorhersehbare Nebenwirkungen durch das Entfernen von Genen immer noch nicht ausgeschlossen werden könnte.
Keimbahn-Manipulation
Deutlich effektiver, aber auch ethisch problematischer, wäre jedoch eine Behandlung von Embryonen, bei denen das Ausbrechen solcher Krankheiten noch verhindert werden könnte. Mit Hilfe des Gene Editing könnten also bereits vor der Geburt ausgeschlossen werden, dass gravierende Krankheiten auftreten – diese würden somit effektiv aus der Vererbung gelöscht. Die meisten Menschen würden dies für Krebs, ALS, Alzheimer, Parkinson und andere schwer degenerative Krankheiten befürworten, doch eine Diskussion darüber, welche Krankheiten auf diese Liste gehören kann schnell zu einer Diskussion über Eugenik führen und darüber welches Leben wert ist gelebt zu werden. An der Frage, ob wir etwa Trisomie 21 zu dieser Liste zählen, hängt eben auch eine gesellschaftliche Anerkennung und die Gleichstellung in Bezug auf den Wert des Lebens von Betroffenen, die heute mit der Chromosomen-Anomalie leben. Ins Extrem gedacht könnten also auch beispielsweise genetische Veranlagungen von Kurzsichtigkeit, Fettleibigkeit oder Kleinwuchs als „nicht erstrebenswert“ bewertet werden. Somit würde das Feld weit geöffnet, wie weit wir die Normierung von Leben als wichtig und richtig erachten, wie wir mit Andersartigkeit umgehen und wer denn diese Normen festlegen kann und darf … eine solche Debatte führt schnell zu der Frage von Moden und idealisierten Körperbildern, von denen wir wissen, dass sie sich je nach kulturellen und zeitgeschichtlichen Entwicklungen stark verändern. Wenn wir diese Moden auf das Gene Editing übertragen, könnten wir durch Keimbahn-Manipulation ganze Generationen maßgeblich durch Trends prägen.
Designerbabies
Noch wichtiger wird diese Überlegung bei der am weitesten von der Realität entfernten und doch von vielen transhumanistischen und science-fictionalen Szenarien imaginierten Möglichkeit der „Bestellung“ menschlicher Merkmale – dem Designerbaby. Mit Transhumanismus ist hier die Vorstellung gemeint, dass der Mensch sich mit allen ihm zur Verfügung stehenden Mitteln weiterentwickelt, um sich immer weiter zu verbessern – Ziel ist dabei die Transzendenz der menschlichen Limitierungen. Mit Hilfe der Gentechnik könne man nun die biologischen Grenzen der menschlichen Existenz überwinden und so einen verbesserten Menschen erschaffen – stärker, schneller, schlauer. Der Vorstellungskraft sind hier kaum Grenzen gesetzt, der Mensch 2.0 könnte genetisch jedem biologisch möglichen Wunsch angepasst werden. Ethisch ist diese Art der Keimbahn-Manipulation äußerst problematisch und zutiefst verwoben mit Fragen zu Machtstrukturen und gesellschaftlichen Normwerten – bei freier Gestaltung des eigenen Kindes, wäre dunkle Haut dann wünschenswert? Und was passiert, wenn ich mir das „IQ-Paket“ nicht leisten kann? Wird es eine genetisch-reiche Elite geben, wie es der Genetiker Lee Silver vorausgesagt hat?
Gattaca
Jede Lerneinheit nutzt als fiktionale Basis der Diskussion einen Science-Fiction-Film, den sich Lernende zum besseren Verständnis eigenständig anschauen können. Für das Thema „Zukunft des Menschen“ empfehlen wir die Sichtung des Films:
Gattaca (US/UK 1997, Regie: Andrew Niccol)
Inhalt
Der Film spielt in der nahen Zukunft, in der die Gentechnik es erlaubt, Kinder nach dem eigenen Wunsch zu gestalten und ihre DNA zu verbessern. Unmodifiziert Geborene haben keine Chance in der neuen Gesellschaft, die Genetik als Definitionskriterium für alle Entscheidungen nimmt. Wer keine perfekte DNA hat, der wird ausgeschlossen. Vincent, ein junger Mann mit natürlicher Geburt, will Astronaut werden, doch seine DNA versperrt ihm den Weg in das Prestigeprogramm Gattaca. Er entschließt sich dazu eine andere, modifizierte Identität anzunehmen und widerlegt damit jeglichen genetischen Determinismus.
Fragen für die Diskussion:
- Welchen Einfluss hat die Genetik auf die dargestellte Gesellschaft?
- Welche Normwerte setzt die Gesellschaft? Was sind die Ideale, die festgelegt werden?
- Was passiert mit Vincent, als dessen „Zukunft“ durch einen Bluttest festgestellt wird? Welche Wirkung hat dieser Determinismus auf ihn?
- Wie verändern sich die Formen der „Identity Politics“ (z.B. Rassismus, Sexismus) durch die Gentechnologie? Welche Machtstrukturen zeigt der Film?
Diskussion zum Film Gattaca mit Prof. Dr. Irene Peters von der Universität Hamburg.
Weiterführende Literatur
- Silver, Lee. Remaking Eden: Cloning and Beyond in a Brave New World . Morrow, 1997.
- Simmons, D. „Genetic inequality: Human genetic engineering“. Nature Education 1.1, 2008. S. 173. https://www.nature.com/scitable/topicpage/genetic-inequality-human-genetic-engineering-768
